L’ammoniaca è un gas incolore, dall’odore pungente, penetrante e caratteristico avente formula NH3 e costituisce il composto di partenza di molte specie tra cui le ammine e i sali di ammonio quaternari.
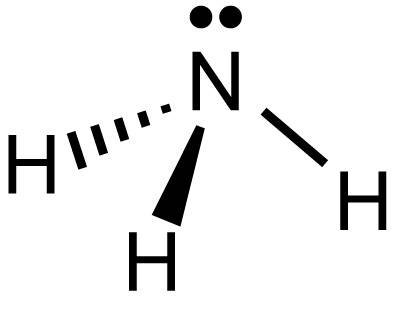
Ha una struttura tetraedrica deformata con angoli di legame H-N-H di circa 108° in cui l’atomo di azoto ibridato sp3 si trova al centro e lega i 3 atomi di idrogeno. La base del tetraedro è costituita da un triangolo equilatero ai cui vertici si trovano i tre atomi di idrogeno mentre il quarto vertice del tetraedro è occupato dal doppietto elettronico solitario dell’azoto.
Grazie al doppietto elettronico presente sull’azoto l’ammoniaca è una base secondo Brønsted-Lowrye dà luogo in acqua a soluzioni basiche con una costante Kb= 1.85 ∙ 10-5 relativa all’equilibrio:
NH3 + H2O ⇌ NH4+ + OH–
L’ammoniaca è una molecola polare e forma legami a idrogeno e dà luogo anche se in misura minore rispetto all’acqua alla autoionizzazione secondo l’equilibrio:
2 NH3 ⇌ NH4+ + NH2–
Tale equilibrio ha infatti una costante K = [NH4+][NH2–] dell’ordine di 10-30 mentre la costante Kw di autoionizzazione dell’acqua è dell’ordine di 10-14.
L’ammoniaca è una molecola polare e pertanto è solubile in acqua oltre che in metanolo, etanolo, etere e cloroformio.
L’ammoniaca fu isolata per la prima volta dal chimico britannico Joseph Priestley nel 1774 e attualmente viene prodotta su scala industriale secondo il processo Haber.
L’ammoniaca è un composto stabile e si decompone in presenza di un catalizzatore metallico come il nichel secondo la reazione:
2 NH3(g) → N2(g) + 3 H2(g)
L’ammoniaca può dare una reazione di combustione in presenza di aria secondo la reazione altamente esotermica:
4 NH3 + 3 O2 → 2 N2 + 6 H2O
Una miscela di aria e ammoniaca fatta passare a 800°C su un catalizzatore di platino e rodio dà luogo alla formazione di monossido di azoto secondo la reazione:
4 NH3 + 5 O2 → 4 NO + 6 H2O
L’ammoniaca può ossidarsi ad azoto molecolare in presenza di alcuni ossidi metallici a caldo; ad esempio:
3 CuO + 2 NH3 → N2 + 3 Cu + 3 H2O
3 PbO + 2 NH3 → N2 + 3 Pb + 3 H2O
L’ammoniaca reagisce con gli alogeni anche se, a seconda dell’alogeno dà luogo alla formazione di prodotti diversi. In presenza di un eccesso di cloro forma tricloruro di azoto e cloruro di idrogeno:
NH3 + 3 Cl2 → NCl3 + 3 HCl
Quando invece l’ammoniaca è in eccesso dà luogo alla formazione di azoto e cloruro di ammonio:
8 NH3 + 3 Cl2 → 6 NH4Cl + N2
Analoga reazione avviene con il bromo:
8 NH3 + 3 Br2 → 6 NH4Br + N2
Quando lo iodio viene fatto reagire con l’ammoniaca anidra a bassa temperatura si forma l’addotto NI3∙NH3 secondo la reazione:
3 NH3 + 3 I2 → NI3∙NH3 + 3 HI
Tale composto può facilmente dar luogo a una reazione esplosiva se viene colpito, secondo la reazione:
8 NI3∙NH3 → 5 N2+ 9 I2 + 6 NH4I
Alla temperatura di 200°C e alla pressione di 80-100 atm l’ammoniaca si combina con il biossido di carbonio per dare urea:
2 NH3 + CO2 → NH2CONH2 + H2O
L’ammoniaca reagisce con metalli alcalini come sodio e potassio per dare rispettivamente sodioammide e potassio ammide e idrogeno gassoso:
2 Na + 2 NH3 → 2 NaNH2 + H2
L’ammoniaca forma composti di coordinazione con numerosi metalli tra cui argento e rame del tipo [Ag(NH3)2]+ e [Cu(NH3)4(H2O)2]2+.
L’ammoniaca è un composto estremamente importante in campo industriale e ha moltissimi utilizzi tra cui:
- Per ottenere rayon o urea
- Per ottenere l’acido nitrico
nel processo Ostwald - Per ottenere il carbonato di sodio nel processo Solvay
- Per ottenere fertilizzanti tra cui l’urea ammonio fosfato
- Come refrigerante
- Per la produzione di esplosivi
- Nelle tinture per capelli
- Come sgrassante di vetri e superfici
Soluzioni diluite di ammoniaca vengono usate per usi domestici come rimedio per le punture di insetti e per eliminare le macchie di vino dai tessuti, per la pulizia di tappeti e moquette, per eliminare l’odore di muffa oltre che come sgrassatore.